
Des chercheurs français ont découvert un peptide qui bloque l’infection du coronavirus in vitro. Un travail qui n’en est qu’à ses débuts mais que les scientifiques imaginent déjà sous la forme d’un spray ou d’une pastille comme alternative à la vaccination
« Les super-propagateurs », qui sont-ils et comment influencent-ils la diffusion du coronavirus ? Le coronavirus continue de se propager et l’apparition successive de clusters localisés fait craindre un retour du virus à une plus grande échelle… Les « super-contaminateurs » sont-ils à l’origine de cette pandémie ?
Développer un vaccin ou un médicament contre le coronavirus est un entreprise de longue haleine et soumise à de nombreux contrôles pour s’assurer de sa innocuité et de son efficacité. C’est pour cela que, malgré les nombreux projets de vaccins lancés après le début de l’épidémie, aucun n’est encore disponible à grande échelle. Il faudra probablement encore de longs mois avant que ce soit le cas.
Des chercheurs du CNRS ont décidé d’explorer une autre voie que celle de la vaccination. En se basant sur la structure tridimensionnelle de la protéine ACE2 humaine, ils ont mis au point des peptides (des petites protéines composées d’une dizaine d’acides aminés) qui piègent définitivement le coronavirus en se fixant sur la protéine S et l’empêchent ainsi de poursuivre son cycle infectieux.
La protéine ACE2 humaine a servi de modèle à la création des peptides. Plus précisément son domaine N-terminal, hélicoïdale, qui concentre de nombreux sites d’interaction avec la protéine S du coronavirus. Une recherche disponible sous la forme d’un préprint, pas encore révisée par les pairs, a été annoncée par un communiqué de presse du CNRS.
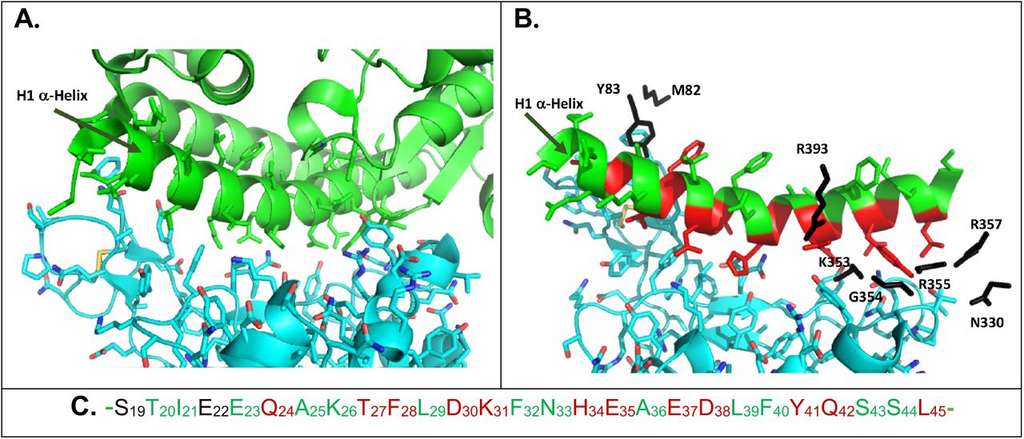
En vert, la structure en hélice de la partie N-terminale de ACE 2 et, en bleu, la protéine spike du coronavirus. © Philippe Karoyan et al. bioRxiv
Des peptides imitant la protéine ACE2
Le cœur des peptides est identique à une séquence de quatre acides aminés de l’hélice H1 de la protéine ACE2. Autour de ce cœur, Philippe Karoyan, chercheur à la Sorbonne, et ses collaborateurs ont rajouté des acides-aminés pour stabiliser la structure hélicoïdale ou améliorer son affinité pour la protéine S. Dix peptides d’une vingtaine de résidus et qui imitent la structure native de H1 ont été ainsi créés. Reste à tester leur efficacité à bloquer le coronavirus.
Pour se faire, des expériences in vitro sur des cellules épithéliales (Vero 6) et pulmonaires (Calu3) en culture ont été réalisées. Les cellules ont été infectées par des coronavirus isolés d’un patient hospitalisé à la Pitié-Salpêtrière. Les scientifiques ont d’abord testé la capacité antivirale des peptides à une concentration de 10 µM pendant 48 heures. Deux peptides (P7 et P8) sont alors sortis du lot. À partir de ces deux candidats prometteurs, deux nouveaux peptides, P9 et P10, ont été synthétisés.
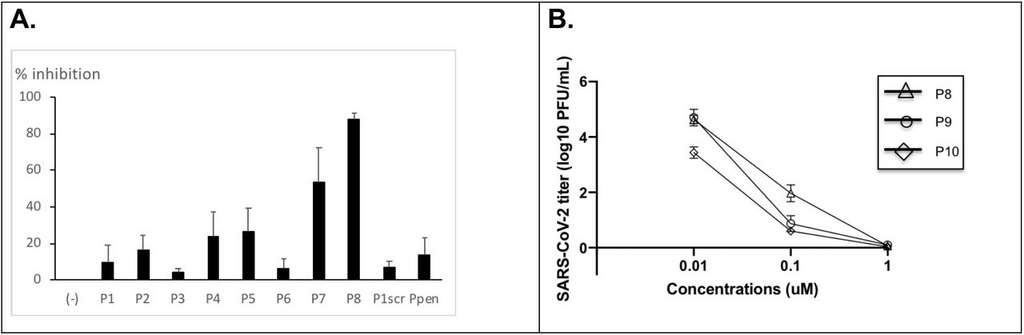
À gauche, le pourcentage d’inhibition du coronavirus pour chaque peptide testé, on voit que le P7 et P8 sont les plus efficaces. À droite, le titre en coronavirus en fonction d’une gamme de concentration croissante des peptides P8, P9 et P10. © Philippe Karoyan et al. bioRxiv
Des peptides efficaces pour bloquer le coronavirus
Les peptides P8, P9 et P10 ont été à nouveau testés mais, cette fois-ci, avec une gamme de concentration croissante (de 0,1 µM à 10 µM). Cela a permis de calculer la dose médiane inhibitrice (IC50) des trois candidats. Elle se situe aux alentours des 85 nM. Cela signifie qu’il n’y a besoin que d’une dose très faible de peptide pour inhiber 50 % de l’infection virale. De plus, aucune cytotoxicité n’a été rapportée lors du premier test.
Philippe Karoyan et son équipe ont également cherché à savoir lequel des trois candidats se fixaient avec le plus d’affinité au domaine RBD de la protéine S virale. Grâce à une technique d’interférométrie qui permet de mesurer les interactions entre deux molécules, ils ont mis en évidence que P9 et P10 se fixaient le mieux au virus.
Pour le moment, leur travail s’arrête ici, mais le groupe du CNRS imagine déjà la suite. Leur peptide pourrait être administré sous la forme d’une pastille à faire fondre sous la langue ou d’un spray oral. Ainsi, les peptides se concentreraient dans la sphère respiratoire supérieure et seraient ensuite dégradés dans le système digestif, sans induire de toxicité. Comme l’annonce le communiqué de presse du CNRS, un brevet a été déposé et le projet est soutenu par l’université de la Sorbonne et la SATT-Lutech, un organisme qui fait le lien entre la recherche fondamentale et les entreprises pour concrétiser les innovations. Affaire à suivre, donc.













